Sekce Zdravotnictví a medicína (Healthcare & Medical) společnosti Trelleborg poskytuje svým zákazníkům podporu při plnění podmínek Nařízení EU o zdravotnických prostředcích 2017/745 (MDR), které bylo vydáno 5. dubna 2017 a které vstoupí plně v platnost v členských státech EU 26. května 2020.

Nařízení se týká zdravotnických prostředků, tj. jakýchkoli nástrojů, přístrojů, zařízení, programového vybavení, implantátů, činidel, materiálů nebo jiných předmětů určených výrobcem k použití, samostatně nebo v kombinaci, pro lidi.
„Jsme si vědomi požadavků vyplývajících z MDR s ohledem na naše materiály použité ve zdravotnických prostředcích," říká Andreas Schmiedel, technický manažer sekce Zdravotnictví a medicína společnosti Trelleborg v Evropě.
„Provedli jsme proto rozsáhlá testování, abychom prokázali, že naše materiály vyhovují přísným požadavkům nových nařízení vztahujících se na tato použití. Jejich splnění je pro nás výzvou, jelikož nařízení vyžaduje soulad i s dalšími normami platnými pro toto použití, jako je např. ISO 10993."
„Splnění požadavků nařízení obnáší ve všech případech nejen testování materiálů, ale vyžaduje také detailní znalost použití, jelikož testované parametry je nutné odvodit z aplikací a z hodnocení rizika daného použití s ohledem na MDR. Shody je možné dosáhnout pouze prostřednictvím velmi pečlivé a úzké spolupráce se všemi zúčastněnými stranami."
„Součástí nabídky sekce Zdravotnictví a medicína společnosti Trelleborg je podpora při odborném posouzení našich materiálů, aby bylo zajištěno, že komponenty, které dodáváme, umožní dodržování velmi přísných podmínek nového nařízení a v nejvyšší možné míře sníží rizika."
Při posuzování souladu s MDR se pozornost zaměřovala na nanomateriály, karcinogenní, mutagenní nebo toxické (CMR) látky, látky narušující činnost endokrinních žláz a ftaláty.
Testování zahrnovalo investice do pokročilých analytických zařízení včetně nákupu integrovaného přístroje GC-MS (plynová chromatografie s hmotnostním spektrometrem), které umožnily realizovat studie podle nejhořších možných scénářů. Veškeré identifikované látky byly poté porovnány s požadavky MDR, aby se zjistily veškeré informace nezbytné pro poskytnutí podpory zákazníkům při uvádění jejich zdravotnických prostředků do souladu s Nařízením EU o zdravotnických prostředcích 2017/745 i s dalšími příslušnými nařízeními a normami.
RSS Sitemap Trends Zásady ochrany osobních údajů Tvorba webových stránek Brno - Webservis © 2023. Všechna práva vyhrazena.







 Ansys spolupracuje se Sony Semiconductor Solutions
Ansys spolupracuje se Sony Semiconductor Solutions Příjemné a pohodové Vánoce
Příjemné a pohodové Vánoce EPLAN a Siemens umožňují bezproblémovou interoperabilitu dat ve strojírenství
EPLAN a Siemens umožňují bezproblémovou interoperabilitu dat ve strojírenství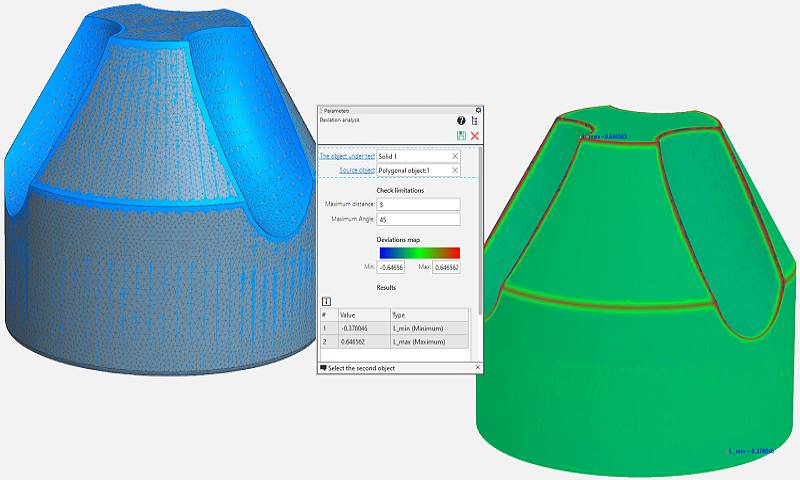 KOMPAS-3D V23 – Reverzní inženýrství, přímé modelování a další ...
KOMPAS-3D V23 – Reverzní inženýrství, přímé modelování a další ...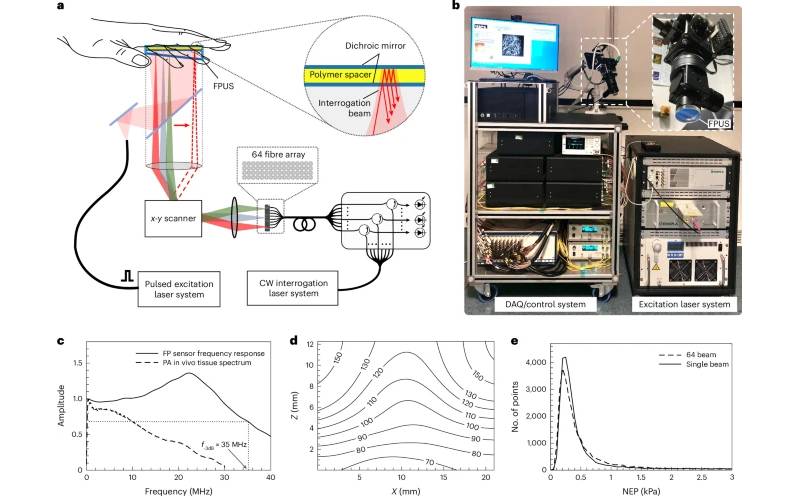 3D skener pro lepší diagnostiku cévních onemocnění
3D skener pro lepší diagnostiku cévních onemocnění





